Science重磅∣首次人體臨床試驗(yàn),限制飲食能延長(zhǎng)壽命
Science重磅∣首次人體臨床試驗(yàn),限制飲食能延長(zhǎng)壽命
2022-02-11,,Science(IF=47.7)上發(fā)表,,限制熱量飲食,能延長(zhǎng)人類壽命,,這是首次人體臨床試驗(yàn)CALERIE的研究結(jié)果,。

2022-02-11,Science(IF=47.7)上發(fā)表,,限制熱量飲食,,能延長(zhǎng)人類壽命,這是首次人體臨床試驗(yàn)CALERIE的研究結(jié)果,。
通訊作者是耶魯大學(xué)醫(yī)學(xué)院的Vishwa Deep Dixit教授,,研究領(lǐng)域是人體代謝和免疫系統(tǒng)之間的相互作用,尋找能控制炎癥和免疫功能障礙的治療靶點(diǎn),。
01 研究背景
大量的研究表明,,限制熱量飲食(caloric restriction,CR),,能延緩多種動(dòng)物與年齡相關(guān)的炎癥疾病發(fā)生,,包括腫瘤,,從而延長(zhǎng)壽命,但大多都停留在動(dòng)物研究階段,,在人體上延長(zhǎng)壽命的效果還未可知,。
在許多動(dòng)物研究中,與正常飲食相比,,減少40%的飲食,,能延長(zhǎng)動(dòng)物壽命,但同時(shí)增加了病毒和寄生蟲感染的嚴(yán)重程度,,包括多種微生物敗血癥的死亡率,,這可能與免疫系統(tǒng)的損壞有關(guān)。
限制熱量飲食(節(jié)食)能延長(zhǎng)壽命,,有助于減肥,,但存在營(yíng)養(yǎng)不良,破壞免疫系統(tǒng),,增加疾病感染的風(fēng)險(xiǎn),,這把雙刃劍,如何“拿捏”,,才能更好的促進(jìn)人類健康,?
02 本研究發(fā)現(xiàn)
本研究通過(guò)一項(xiàng)長(zhǎng)期節(jié)食的人體臨床試驗(yàn)CALERIE-II(Comprehensive Assessment of Long-term Effects of Reducing Intake of Energy clinical trial)分析表明,健康人2 年內(nèi)約14%限制熱量飲食(CR)不會(huì)導(dǎo)致營(yíng)養(yǎng)不良,,并能改善免疫系統(tǒng)胸腺的生成,,減少與年齡相關(guān)的炎癥發(fā)生。
同時(shí),,本研究還發(fā)現(xiàn)了一個(gè)關(guān)鍵的調(diào)控靶點(diǎn):血小板活化因子乙酰水解酶 (PLA2G7),。減少PLA2G7基因表達(dá),能降低小鼠與年齡相關(guān)炎癥的發(fā)生,,延長(zhǎng)健康壽命,。
03 本研究CALERIE 臨床試驗(yàn)簡(jiǎn)介
減少能量攝入長(zhǎng)期影響的綜合評(píng)估 (CALERIE) 臨床試驗(yàn)的目的,是測(cè)試 2 年限制熱量飲食(CR)對(duì)生理學(xué),、衰老生物標(biāo)志物和健康志愿者的健康期(health span)和壽命的預(yù)測(cè),。
基線(隨意狀態(tài))的能量攝入通過(guò)借助雙重標(biāo)記的水,在兩個(gè)連續(xù) 14 天的每日總能量消耗(total daily energy expenditure,,TDEE)測(cè)量來(lái)評(píng)估,。使用攝入平衡法對(duì) 6 個(gè)月間隔內(nèi)的average % CR 進(jìn)行回顧性計(jì)算,該方法涉及使用雙標(biāo)水同時(shí)測(cè)量 TDEE 以及身體成分的變化,。
本研究的CALERIE臨床試驗(yàn),,在自由生活條件下,實(shí)現(xiàn)了人類在2年內(nèi)約 14% 的持續(xù)限制熱量飲食(CR),。
04 限制熱量飲食(CR)改善人類胸腺功能
胸腺的衰老先于其他器官的衰老,,其特征是胸腺脂質(zhì)積累增加,及T細(xì)胞增殖減少,。因此本研究使用磁共振成像 (MRI) 和信號(hào)偶聯(lián) T 細(xì)胞受體刪除環(huán)(signal-joint T cell receptor excision circles,,sjTRECs)的量化,研究限制熱量和不限制熱量的人的胸腺之間的功能差異,。
與基線相比,,持續(xù) 2 年的 CR 顯著(P < 0.05)增加了研究參與者的胸腺質(zhì)量(圖1B)以及總胸腺體積。
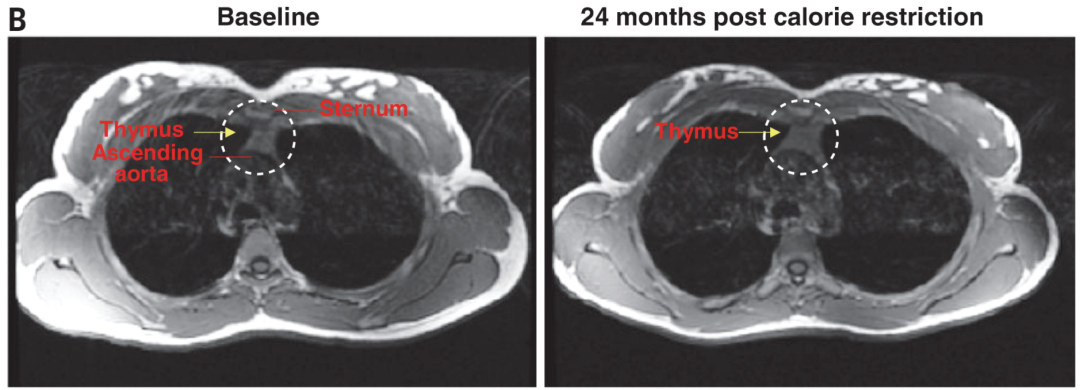
胸腺的磁共振成像 (MRI)
對(duì)參與者的外周血 CD4 T 細(xì)胞進(jìn)行了 RNA 測(cè)序,,以測(cè)量轉(zhuǎn)錄變化,。主成分分析(PCA)(圖1F)和多維尺度(MDS)分析顯示 CR 對(duì) CD4 T 細(xì)胞中的基因表達(dá)沒(méi)有影響。這些數(shù)據(jù)表明,,健康人 14% 的 CR 激活了一種組織保護(hù)性免疫代謝程序,,可以在不改變 CD4 T 細(xì)胞轉(zhuǎn)錄組的情況下增強(qiáng)胸腺功能。
限制熱量飲食(CR)對(duì)CD4 T細(xì)胞的影響
限制熱量攝入,,不僅能使胸腺體積增加,,而且胸腺脂肪也減少了,而不限制熱量攝入組的胸腺功能體積沒(méi)有變化(圖1G),。
限制熱量飲食(CR)對(duì)胸腺脂肪的影響
05 限制熱量飲食(CR)抗衰老免疫代謝檢查點(diǎn)(immunometabolic checkpoints)
人類2年的CR能調(diào)節(jié)營(yíng)養(yǎng)感應(yīng),、炎癥和長(zhǎng)壽有關(guān)的核心途徑(圖2C),例如:
增加線粒體生物合成和過(guò)氧化物酶體增殖物激活受體(PPAR-α)驅(qū)動(dòng)的脂肪酸氧化,,包括增加胰島素信號(hào)成分的表達(dá),表明胰島素敏感性增強(qiáng),。
上調(diào)單羧酸鹽如乳酸,、丙酮酸和酮體的質(zhì)子耦合轉(zhuǎn)運(yùn)
誘導(dǎo)人體脂肪組織中的 BMAL1 時(shí)鐘通路和 sumoylation,,這與介導(dǎo) CR 的一些長(zhǎng)壽效應(yīng)有關(guān),;
降低先天免疫激活成分的表達(dá),例如溶酶體中的抗原加工途徑,、補(bǔ)體級(jí)聯(lián)反應(yīng)和非經(jīng)典核因子-κB 信號(hào)傳導(dǎo);
降低細(xì)胞外基質(zhì)沉積成分的表達(dá),,這可能反映較低的炎癥;
增加含有二甲基苯胺單加氧酶 2 (FMO-2) 的黃素的基因表達(dá),,該酶的活性增加與秀麗隱桿線蟲的壽命延長(zhǎng)有關(guān)。
此外,,來(lái)自整個(gè)脂肪組織的 RNA 測(cè)序數(shù)據(jù)的反卷積揭示了一種抗炎組織反應(yīng),,同時(shí)巨噬細(xì)胞特異性轉(zhuǎn)錄物減少,。
這些數(shù)據(jù)表明,,人類的CR引發(fā)了可能改善脂肪組織代謝的抗炎途徑,。
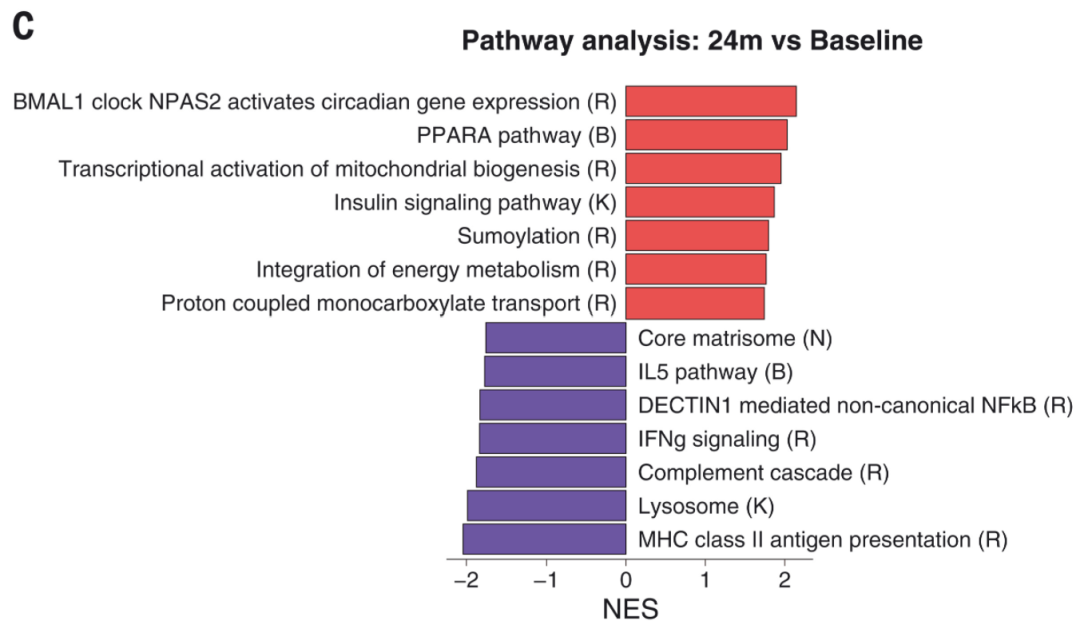
限制熱量飲食(CR)調(diào)節(jié)營(yíng)養(yǎng)感應(yīng)、炎癥和長(zhǎng)壽有關(guān)的核心途徑
既然CR可降低炎癥,,研究人員使用脂肪組織 RNA 測(cè)序數(shù)據(jù)的生物信息學(xué)反卷積研究了CR對(duì)骨髓細(xì)胞中基因表達(dá)的影響,。限制熱量飲食(CR)后,骨髓細(xì)胞中的幾個(gè)促炎基因及未知功能的基因被特異性抑制(圖 2G),,其中包括血小板活化因子乙酰水解酶 (PLA2G7),,是由巨噬細(xì)胞分泌。
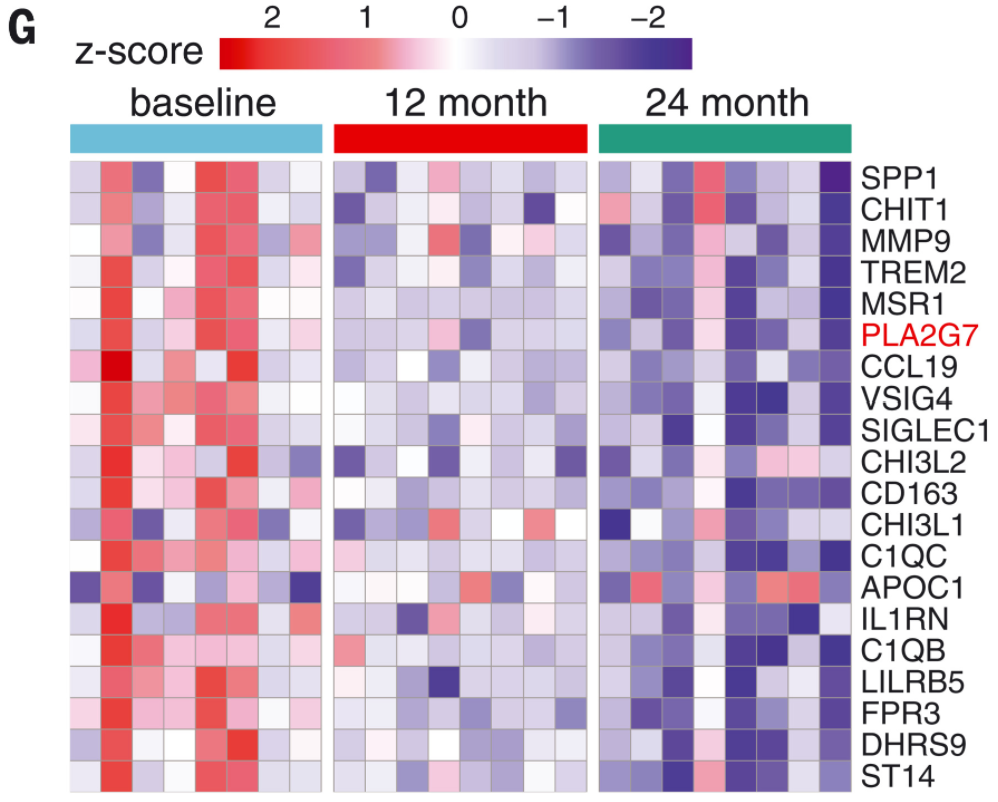
限制熱量飲食(CR),,能抑制多個(gè)基因表達(dá)(如PLA2G7)
06 PLA2G7基因敲除動(dòng)物實(shí)驗(yàn)
PLA2G7 可降解血小板激活因子并通過(guò)降解 OxPAPC來(lái)調(diào)節(jié)炎癥小體激活,,為了研究PLA2G7 的缺失是否會(huì)影響炎癥,進(jìn)行了PLA2G7基因敲除小鼠實(shí)驗(yàn),。
PLA2G7敲除小鼠能以正常的孟德爾頻率出生,,與對(duì)照相比,PLA2G7 缺陷型動(dòng)物能免受高脂飲食(HFD)誘導(dǎo)的體重增加和脂肪量增加,。此外,,與同窩對(duì)照相比,Pla2g7 KO 小鼠部分免受肝脂肪變性(圖3D),。
PLA2G7能調(diào)節(jié)NLRP3炎癥小體的激活,而減少PLA2G7可以使小鼠免受炎癥的侵襲,。
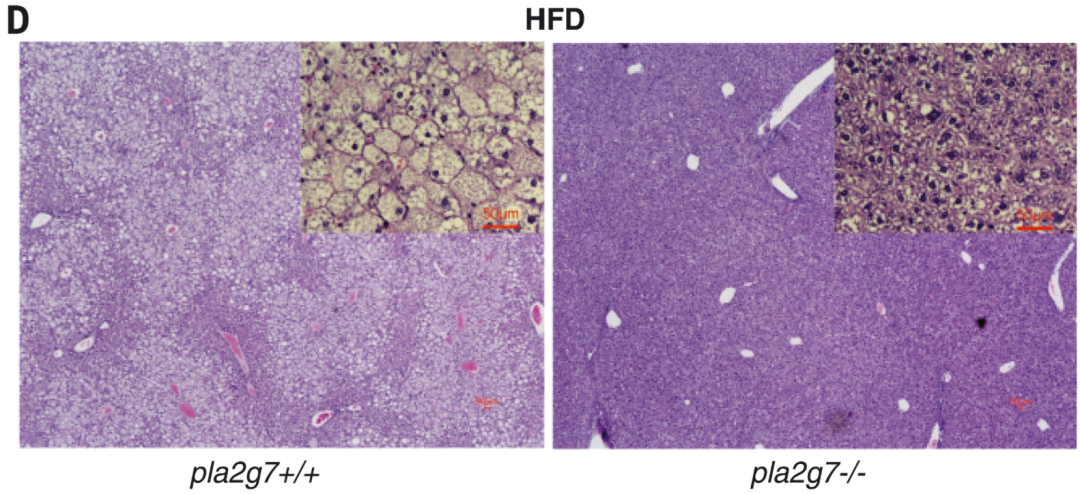
小鼠肝臟免疫組化染色
24 個(gè)月大的 PLA2G7 缺陷小鼠(類似于約 70 歲的人類)具有更大的胸腺和更高的胸腺細(xì)胞豐度(圖4L),,并且受到保護(hù)免受與年齡相關(guān)的胸腺退化(圖4M)。
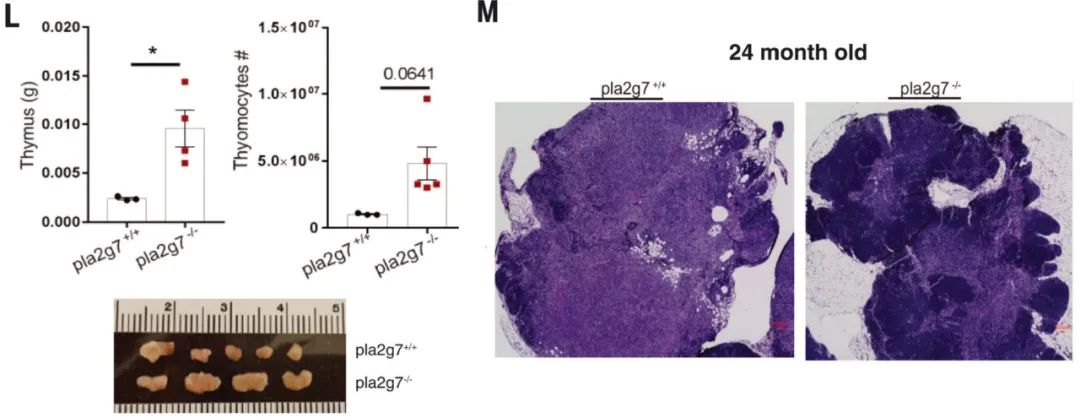
敲除PLA2G7基因能防止胸腺萎縮及胸腺退化
人類限制熱量飲食(CR)引起的PLA2G7減少可能有助于更好的脂肪組織代謝,、降低炎癥和減少胸腺脂肪萎縮,。
07 總結(jié)
這項(xiàng)研究表明,持續(xù)的適度限制熱量(14%),,能促進(jìn)免疫功能,、減少炎癥,延長(zhǎng)健康壽命,。并發(fā)現(xiàn)了PLA2G7是潛在的調(diào)控靶點(diǎn),,闡明了其調(diào)控的機(jī)制,奠定了理論基礎(chǔ),。
文章鏈接:
https://www.science.org/doi/full/10.1126/science.abg7292
DOI: 10.1126/science.abg7292
本文版權(quán)歸原作者所有,,文章內(nèi)容不代表平臺(tái)觀點(diǎn)或立場(chǎng)。如有關(guān)于文章內(nèi)容、版權(quán)或其他問(wèn)題請(qǐng)與我方聯(lián)系,,我方將在核實(shí)情況后對(duì)相關(guān)內(nèi)容做刪除或保留處理,!